概要
私達はがん微小環境の独自の解析手法を開発して免疫系とがん細胞の相互作用を網羅的に解析し、がん細胞が持つ遺伝子異常が免疫応答に直接影響を与えるという概念を構築して腫瘍生物学の新たな分野を開拓しています。免疫系は遺伝学的/環境要因的多様性に左右される高次生体システムであることから、がん患者の網羅的解析データから免疫応答に関わる要素を抽出して個々の要素についてマウスモデルでその普遍的な意義を検証する、ヒトからマウスへという新たな試みによりヒトの多様性を科学し、がんという疾患の病態解明を目指します。
メンバー
教員





研究・教育について
がん免疫療法の臨床応用は、ヒトにおいて「免疫監視の再起動」が可能であることを証明しました。しかし治療効果に個人差があることから、がん側の遺伝子多様性、宿主側の遺伝学的多様性に加えてエネルギー・物質代謝などの環境因子によっても免疫監視の再起動は左右されることが明らかになってきました。これらの多様性に対して免疫学、ゲノム医科学、代謝学およびバイオインフォマティクスを統合した研究を進めることで「免疫寛容⇄免疫監視の調節機構」の解明を進めていきます。個々の免疫細胞の1細胞レベルの分子発現、時空間動態変化からミクロ細胞動態を捉えるとともに、細胞間のネットワークの変化から組織・個体レベルのマクロ生物学的視点での理解につなげます。このため、ヒトのがん組織での位置および時間情報を伴った網羅的分子発現および細胞機能解析結果を基盤として免疫細胞を細胞系譜ごとに追跡解析可能な遺伝子改変マウスに展開した融合研究を進めます。また、AMEDムーンショット事業で生体の正常組織細胞が慢性炎症等の誘因によって体細胞変異を獲得し「がん」になる過程での免疫応答の動態についても解明し、予防医学への展開を図っていきます。
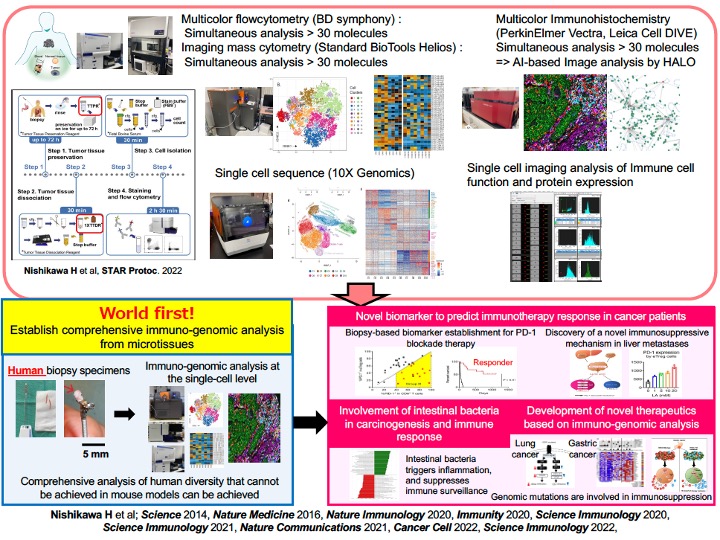
がん細胞および免疫細胞を1細胞レベルで解析する(免疫のゲノム解析)研究を進める体制と研究機器。またそれによるこれまでの研究成果の一部の紹介。
Selected Publications
Kumagai S, Itahashi K, Nishikawa H: Regulatory T cell-mediated immunosuppression orchestrated by cancer: towards an immuno-genomic paradigm for precision medicine. Nat Rev Clin Oncol. 21(5):337-353. 2024. DOI: 10.1038/s41571-024-00870-6
Itahashi K, Irie T, Yuda J, Kumagai S, Tanegashima T, Lin Y-Z, Watanabe S, Goto Y, Suzuki J, Aokage K, Tsuboi M, Minami Y, Ishii G, Ohe Y, Ise W, Kurosaki T, Suzuki Y, Koyama S, Nishikawa H: BATF epigenetically and transcriptionally controls the activation program of regulatory T cells in human tumors.Sci Immunol 14;7(76):eabk0957 2022.
Kumagai S, Koyama S, Itahashi K, Tanegashima T, Lin Y-T, Togashi Y, Kamada T, Irie T, Okumura G, Kohno H, Ito D, Fujii R, Watanabe S, Sai A, Fukuoka S, Sugiyama E, Watanabe G, Owari T, Nishinakamura H, Sugiyama D, Maeda Y, Kawazoe A, Yukami H, Cida K, Ohara Y, Yoshida T, Shinno Y, Takeyasu Y, Shirasawa M, Nakama K, Aokage K, Suzuki J, Ishii G, Kuwata T, Sakamoto N, Kawazu M, Ueno T, Mori T, Yamazaki N, Tsuboi M, Yatabe Y, Kinoshita T, Doi T, Shitara K, Mano H, Nishikawa H: Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments. Cancer Cell.40(2):201-218.e9 2022. DOI: https://doi.org/10.1016/j.ccell.2022.01.001
Kumagai S, Togashi Y, Kamada T, Sugiyama E, Nishinakamura H, Takeuchi Y, Kochin V, Itahashi K, Maeda Y, Matsui S, Shibahara T, Yamashita Y, Irie T, Tsuge A, Fukuoka S, Kawazoe A, Udagawa H, Kirita K, Aokage K, Ishii G, Kuwata T, Nakama K, Kawazu M, Ueno T, Yamazaki N, Goto K, Tsuboi M, Mano H, Doi T, Shitara K, Nishikawa H: The PD-1expression balance between effector and regulatory T cell predicts the clinical efficacy of PD-1 blockade therapies. Nat Immunol.21(11):1346-1358 2020.
Kumagai S, Togashi Y, Sakai C, Kawazoe A, Kawazu M, Ueno T, Sato E, Kuwata T, Kinoshita T, Yamamoto M, Nomura S, Tsukamoto T, Mano H, Shitara K, Nishikawa H: An oncogenic alteration creates a tumor microenvironment that promotes tumor progression by conferring a metabolic advantage to regulatory T cells. Immunity. 53(1):187-203.e8 2020. DOI: 10.1016/j.immuni.2020.06.016
採用情報&連絡先
やる気のある学生と博士研究員を常時募集しています。
CCIIのお問い合わせフォームをご利用いただくか、recruit_ccii@mail2.adm.kyoto-u.ac.jpまで直接メールをお送りください。部門の名前をご記入ください。
